Galvanik und Ladungsdiffusion¶
Ladungstransport in Flüssigkeiten¶
Reines Wasser ist ein Isolator; enthält es allerdings gelöste Salze, Säuren oder Basen, so gibt es Ionen als frei bewegliche Ladungsträger. Eine derartige Lösung wird als Elektrolyt bezeichnet.
Taucht man zwei metallische Elektroden in einen Elektrolyt ein und legt eine elektrische Spannung an, so bewegen sich die positiv geladenen Ionen (Kationen) zur negativen Elektrode (Kathode); ebenso bewegen sich die negativ geladenen Ionen (Anionen) zur positiven Elektrode (Anode). Durch die Ionenbewegung findet also sowohl ein Ladungs- wie auch ein Materie-Transport statt.
An der negativ geladenen Kathode werden die positiven Ladungen der Kationen neutralisiert. Die abgegebene elektrische Ladung wird über die Spannungsquelle zur positiven Anode „gepumpt“, wo entsprechend die negativen Ladungen der Anionen neutralisiert werden. Als Folge dieses Ionentransports, der auch Elektrolyse genannt wird, setzen sich also positive geladenen Metall- beziehungsweise Wasserstoff-Ionen an der Kathode ab, während sich an der Anode negativ geladene Sauerstoff-Ionen beziehungsweise Säurereste absetzen.
Die Faradayischen Gesetze
Die Faradayischen Gesetze beschreiben den Zusammenhang zwischen der bei einer
Elektrolyse transportierten Ladung 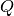 und der an den Elektroden
abgeschiedene Masse
und der an den Elektroden
abgeschiedene Masse 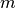 :
:
Bei einfach geladenen Ionen ist die von einer Elektrode aufgenommene Masse
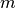 proportional zur aufgenommenen beziehungsweise abgegebenen
Ladungsmenge
proportional zur aufgenommenen beziehungsweise abgegebenen
Ladungsmenge 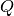 :
:
Um ein Mol eines Stoffes an einer Elektrode abzuscheiden, muss die Ladungsmenge
 abgegeben
werden, wobei die Avogadro-Konstante
abgegeben
werden, wobei die Avogadro-Konstante ![N_{\mathrm{A}} = \unit[6,022 \cdot
10^{23}]{\frac{1}{mol}}](../_images/math/cc00c80c8530dabfc59c71f4a4c56c7d2b813c38.png) die Anzahl der Teilchen je Mol und
die Anzahl der Teilchen je Mol und ![e=\unit[1,6
\cdot 10^{-19}]{C}](../_images/math/1911d0209620c1d4e657d16fb7550f457b05469f.png) die Elementarladung angibt.
die Elementarladung angibt.Bei mehrfach geladenen Ionen ist die von einer Elektrode aufgenommene Masse
Für eine Spannungserzeugung durch eine chemische Umsetzung sind zwei verschiedene Werkstoffe und eine stromleitende Flüssigkeit (Elektrolyt) notwendig.
Elektrolytische Spannungsreihe
| Material | Spannung |
| Lithium | -3.045V |
| Kalium | -2.92V |
| Calcium | -2.76V |
| Natrium | -2.71V |
| Magnesium | -2.34V |
| Aluminium | -1.67V |
| Mangan | -1.07V |
| Zink | -0.76V |
| Chrom | -0.56V |
| Eisen | -0.44V |
| Cadmium | -0.40V |
| Nickel | -0.23V |
| Zinn | -0.14V |
| Blei | -0.12V |
| Wasserstoff | -0.00V |
| Kupfer | +0.35V |
| Kohle | +0.74V |
| Silber | +0.80V |
| Quecksilber | +0.80V |
| Platin | +1.20V |
| Gold | +1.40V |
Je nachdem welche chemischen Elemente kombiniert werden, erhält man durch Zugabe eines Elektrolyts unterschiedliche Spannungen.
Elektrochemische Korrosion:
Grund für die elektrochemische Korrosion: Durch zwei unterschiedliche Metalle und ein Elektrolyt entsteht ein galvanisches Element. Abhilfe schafft beispielsweise Lackieren oder Fetten.
